干货分享|深度解析AAV载体在基因治疗中的原理、实践与前景
发布时间:2025-06-11 16:43分类: 无 浏览:181评论:0

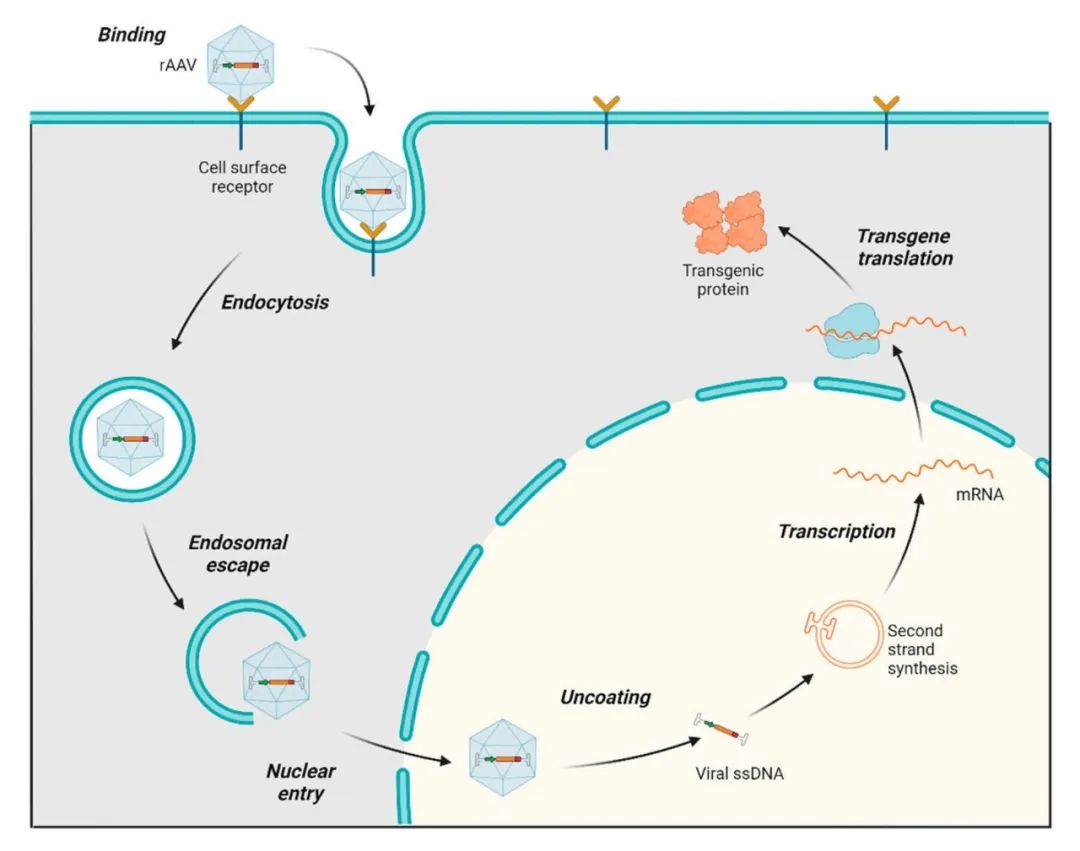
基因治疗的成功高度依赖于高效、安全的基因递送系统。当前基因治疗主要依赖于两类基因递送系统:病毒载体与非病毒载体。病毒载体,如腺相关病毒(AAV)和慢病毒,因具备天然的细胞侵染能力,能够实现高效的基因递送;相比之下,非病毒载体,如脂质纳米颗粒、阳离子聚合物,虽在免疫原性控制与成本方面具有一定优势,但在递送效率、细胞存活率及靶向能力等方面仍存在一定局限。
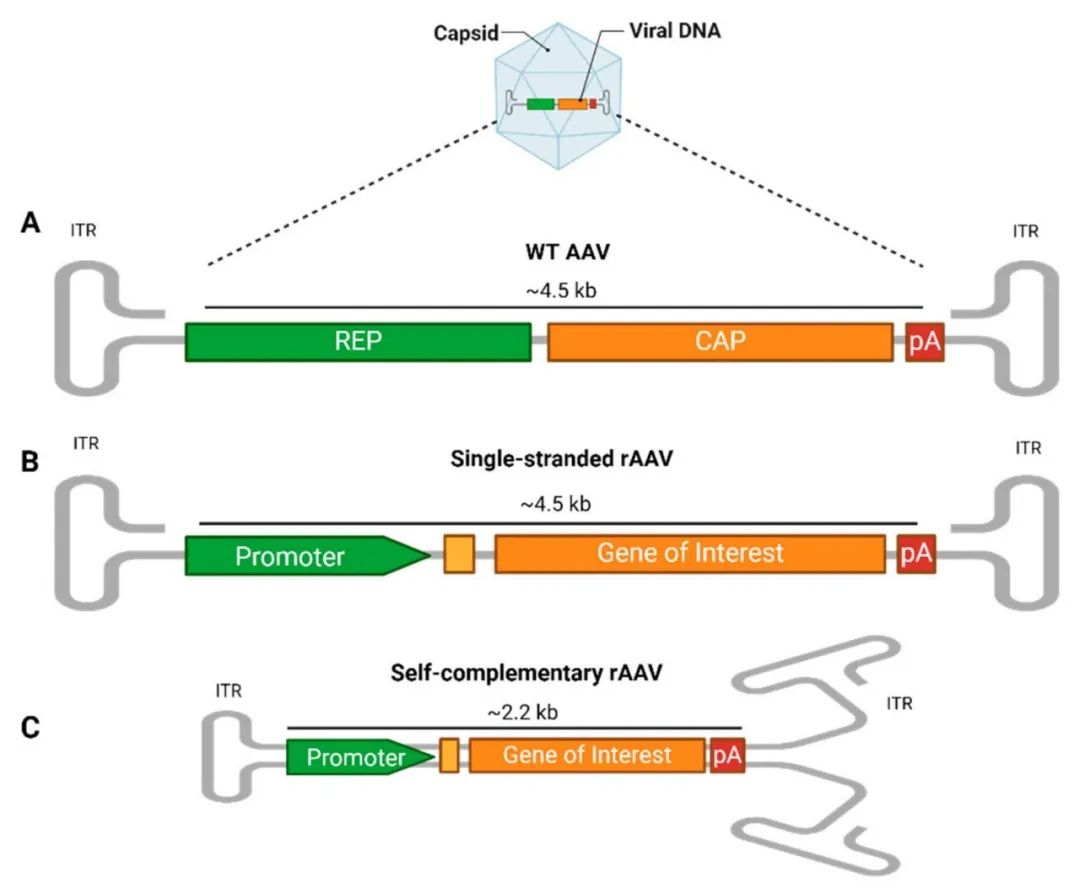
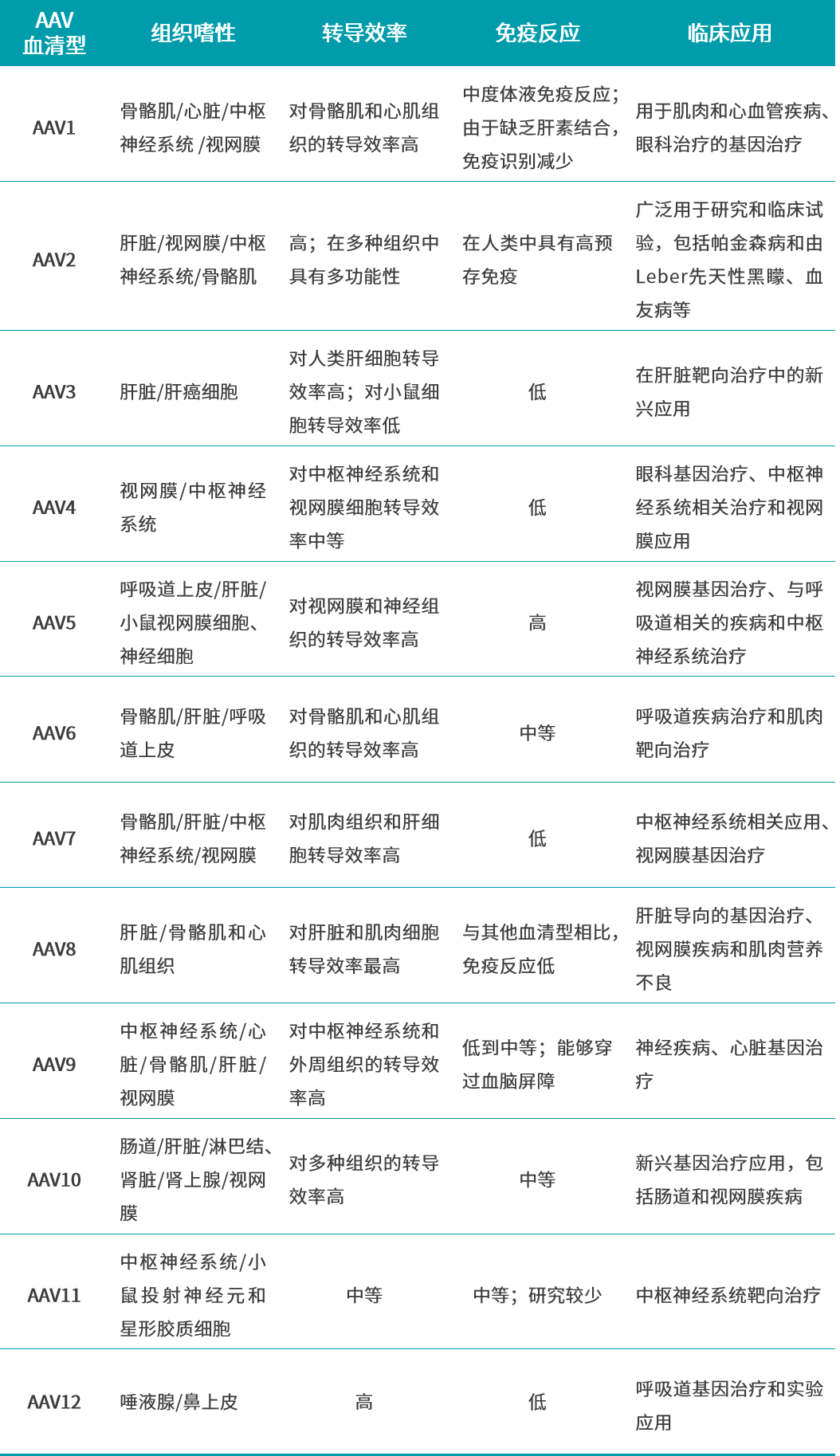
在众多病毒载体中,AAV因其低致病性与低免疫原性、广泛的细胞感染能力以及长期稳定表达外源基因的特性,成为最具潜力的载体之一。AAV递送的基因组通常以附加体形式存在,不整合入宿主细胞基因组,从而显著降低了插入性突变的风险,提高了治疗的安全性。



VectorBuilder云舟生物是世界知名分子生物学家蓝田博士创办的基因递送领军企业,在全球设有10余家子公司和办事处,2023年晋升为全球独角兽企业。
云舟生物独创“载体家”平台,开启了个性化基因载体的商品化时代;目前已赋能全球90多个国家和地区,为超过4500家顶尖科研院校和制药公司提供服务,在QS前100高校的客户覆盖率达到了90%,全球TOP30药企的客户覆盖率亦超过90%,产品成果的全球文献引用量逾5000篇。
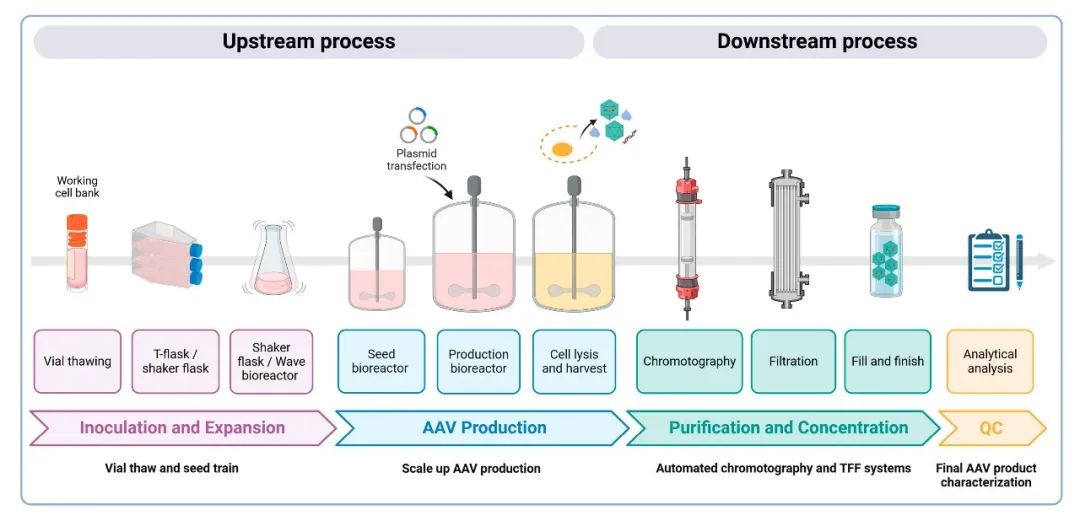
云舟生物的基因药物CRO、CDMO项目遍布北美、欧洲、日本等多个国家和地区,已成功助力全球数十个项目成功开展IIT或IND研究,其中GMP级别的质粒和慢病毒载体已获得美国FDA的IND正式批准,用于在美国的多中心临床试验。
云舟生物致力于系统性攻克基因递送行业的关键技术瓶颈,为行业和世界创造不可取代的价值。






- 排行

