在胃癌微环境中,肿瘤相关巨噬细胞(TAMs)扮演着关键的免疫调控角色,尤其是促肿瘤的M2型巨噬细胞。M2型巨噬细胞不仅能够抑制抗肿瘤免疫反应,还通过促进肿瘤细胞增殖、侵袭和转移,加速胃癌的进展。
外泌体作为细胞间通讯的重要媒介,具有独特的生物学功能。它们是由细胞分泌的小型膜囊泡,能够携带多种生物活性分子,包括蛋白质、mRNA、miRNA和其他非编码RNA等。这些分子可以通过外泌体的传递,在受体细胞中引发一系列的生物学反应,从而在生理和病理过程中发挥重要作用。
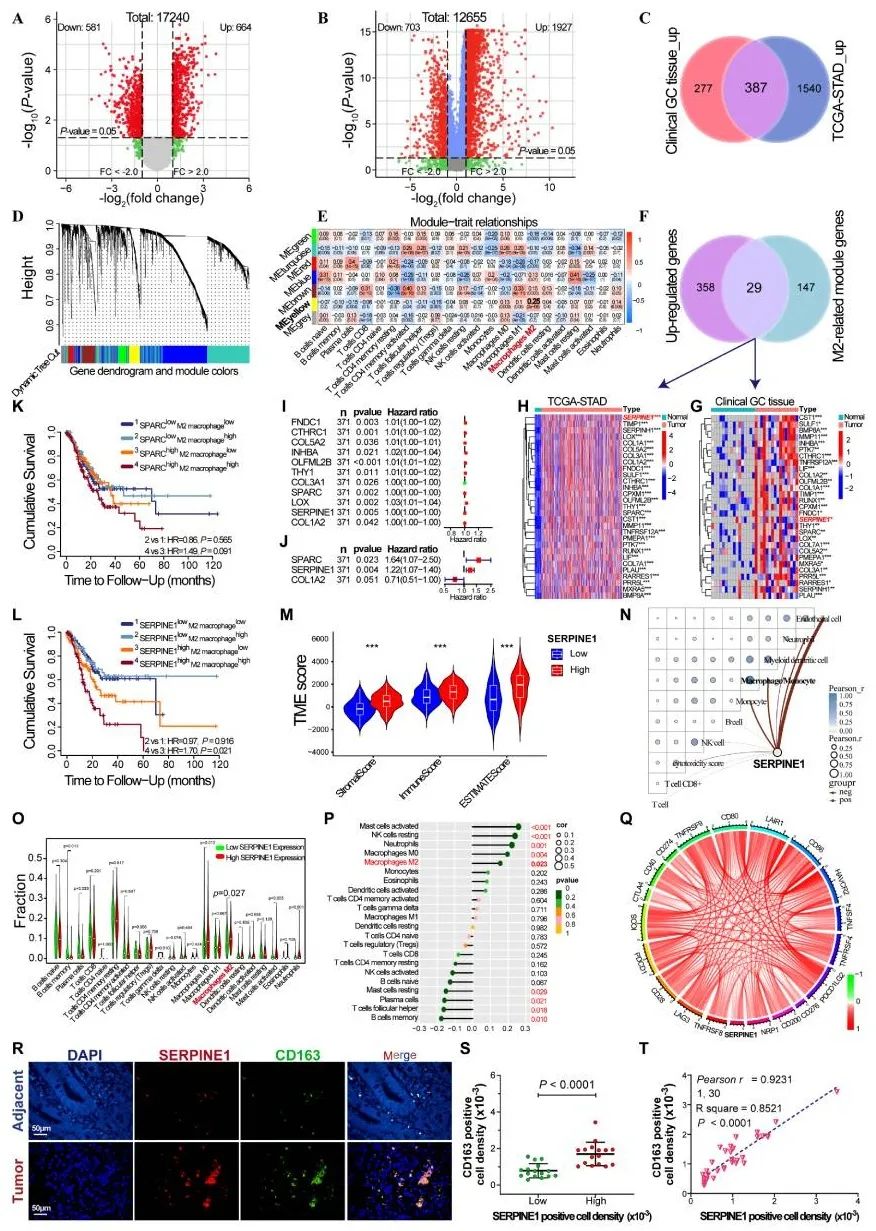
在胃癌中,肿瘤细胞可以利用外泌体将这些分子传递给巨噬细胞,诱导巨噬细胞从抗肿瘤的M1型转化为支持肿瘤发展的M2型,从而塑造一个有利于肿瘤生长和免疫逃逸的微环境。因此,调节肿瘤来源外泌体中某些物质的表达以抑制M2极化或促进M1型转化可能是重塑免疫抑制性肿瘤微环境和提高抗肿瘤疗效的有效策略。基于此,2025年1月,兰州大学焦作义团队在Journal of Experimental & Clinical Cancer Research上发表了题为 “Gastric cancer-derived exosomal let-7 g-5p mediated by SERPINE1 promotes macrophage M2 polarization and gastric cancer progression” 的论文。该研究揭示了SERPINE1通过外泌体调控胃癌微环境中巨噬细胞极化的分子机制,为靶向胃癌免疫微环境的治疗提供了新思路。研究团队通过16对胃癌及癌旁组织的mRNA微阵列分析和TCGA-STAD队列的差异mRNA分析,筛选出与M2巨噬细胞浸润及患者预后相关的关键基因。结果显示,SERPINE1在胃癌组织中高表达,与患者的不良预后、晚期临床分期(III-IV期)和M2型巨噬细胞的高浸润显著相关。M2型巨噬细胞具有免疫抑制和促肿瘤功能,在胃癌微环境中发挥关键作用。免疫组化分析进一步显示,SERPINE1高表达与M2型巨噬细胞标志物(如CD206)的高表达高度相关。TIMER数据库分析表明,SERPINE1高表达与M2巨噬细胞浸润呈正相关,且患者总生存期(OS)显著缩短。通过单变量和多变量Cox回归分析,确定SERPINE1是胃癌患者的独立预后因素。以上结果表明,SERPINE1在胃癌发生发展中具有重要作用,可作为潜在的预后指标和治疗靶点。▲图1 筛选与M2型巨噬细胞和胃癌预后相关的基因
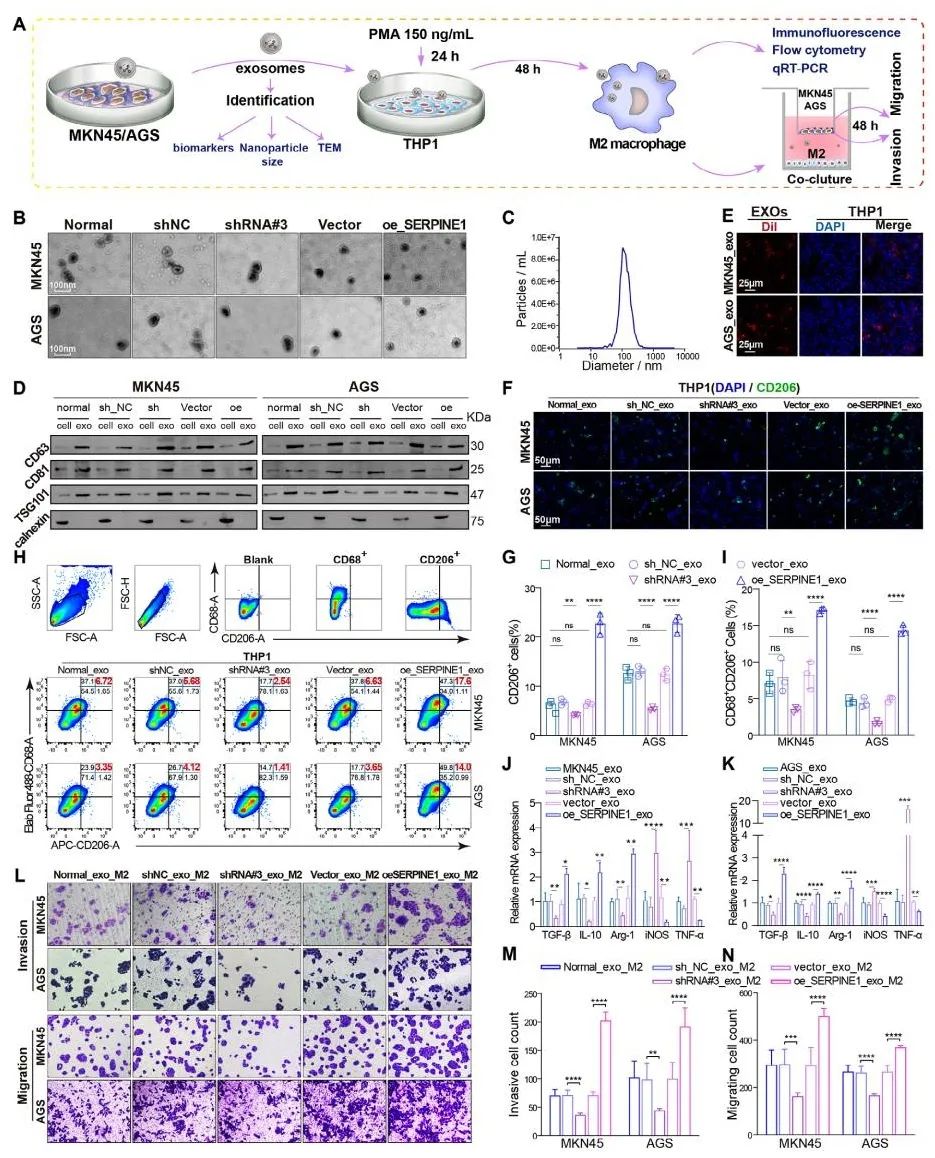
为探讨SERPINE1对巨噬细胞M2极化的影响,研究通过单细胞测序发现SERPINE1在胃癌细胞中高表达,为其在微环境中的作用提供了证据。利用胃癌细胞(MKN45或AGS)与THP-1细胞的体外共培养模型,发现高表达SERPINE1的胃癌细胞显著增强了THP-1细胞向M2型极化的能力(如CD206和Arg-1高表达)。通过构建SERPINE1敲低与过表达胃癌细胞,验证其对M2型极化的调控作用。敲低SERPINE1显著抑制M2极化,过表达则进一步增强。此外,使用外泌体抑制剂GW4689 部分逆转了SERPINE1促进的M2极化效应,证明这一过程依赖外泌体信号传递。RNA-seq分析表明,SERPINE1通过外泌体或细胞间信号调控巨噬细胞表型。结果表明,SERPINE1是巨噬细胞M2极化的重要调控因子。
▲图2 胃癌细胞中高表达的SERPINE1促进巨噬细胞向M2型极化
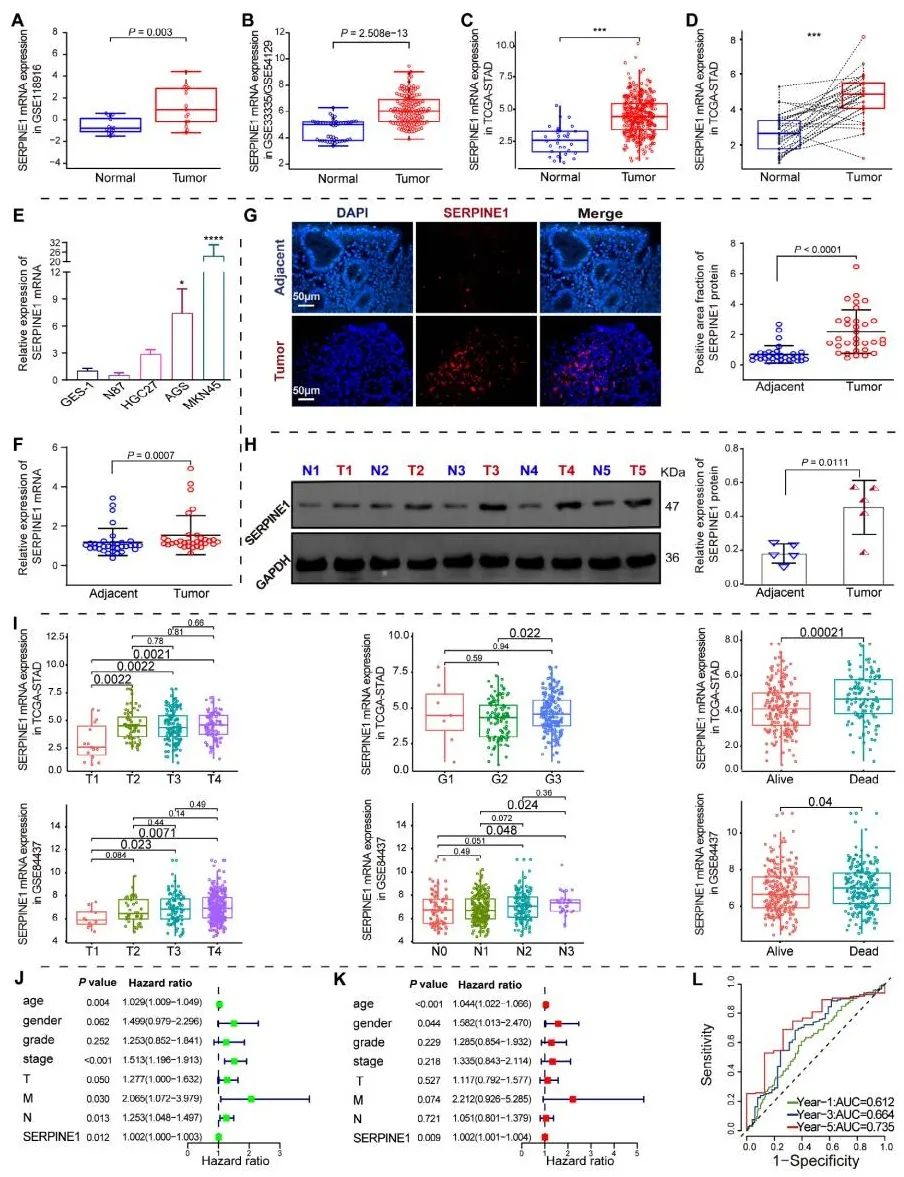
分析不同分期胃癌患者的肿瘤组织样本发现,SERPINE1在晚期患者(III-IV期)中高表达,且具有更高迁移和侵袭能力的胃癌细胞中SERPINE1表达显著升高。通过TCGA-STAD队列单变量与多变量Cox回归分析,进一步确定SERPINE1是独立的预后预测因子。利用ROC曲线评估SERPINE1对1年、3年和5年OS的预测价值,显示其在胃癌预后评估中具有显著的诊断价值。体内外实验表明,高表达SERPINE1促进胃癌细胞增殖、迁移和侵袭,而敲低SERPINE1则显著抑制这些恶性表型。综上,SERPINE1不仅是胃癌进展的重要标志分子,还可能是驱动胃癌恶性表型的关键因子。▲图3 SERPINE1的差异表达与胃癌患者预后分析体外实验表明,过表达SERPINE1的胃癌细胞表现出显著增强的增殖、迁移和侵袭能力,而敲低SERPINE1则抑制了这些恶性表型。在小鼠模型中,移植了过表达SERPINE1的胃癌细胞的小鼠肿瘤生长更快,体积更大,且伴随更高的M2型巨噬细胞浸润。此外,敲低SERPINE1的小鼠模型则表现出肿瘤增殖和浸润能力的显著下降。这些结果证实了SERPINE1通过促进胃癌细胞的恶性表型和调控肿瘤微环境共同推动了胃癌的进展。

▲图4 SERPINE1在体内和体外促进胃癌细胞的增殖
SERPINE1通过外泌体影响巨噬细胞的M2型极化
为验证SERPINE1是否通过外泌体调控巨噬细胞极化,研究从沉默或过表达SERPINE1的胃癌细胞中提取外泌体,并使用纳米颗粒追踪分析(NTA)鉴定外泌体浓度和质量。结果显示,外泌体质量一致,具典型特征。实验表明,高表达SERPINE1的胃癌细胞分泌的外泌体显著增强了THP-1细胞向M2型极化的转化能力,表现为M2型标志物(如CD206、Arg-1)表达升高。通过qRT-PCR和流式细胞术 验证,SERPINE1外泌体的诱导作用显著高于敲低SERPINE1的细胞分泌的外泌体。此外,从胃癌患者血浆中分离的外泌体也发现,SERPINE1高表达患者的外泌体更易诱导M2型巨噬细胞极化。▲图5 SERPINE1介导的胃癌细胞外泌体促进THP1细胞向M2型巨噬细胞极化外泌体中富含的miRNA let-7g-5p是调控巨噬细胞极化的关键分子。通过sRNA-Seq分析鉴定,发现高表达SERPINE1的胃癌细胞分泌的外泌体中let-7g-5p显著上调,而SERPINE1沉默导致let-7g-5p显著下调。实验通过流式细胞术验证,let-7g-5p通过下调SOCS7(STAT3信号的抑制因子)表达,解除对STAT3磷酸化的抑制作用,从而促进巨噬细胞M2型极化。此外,Co-IP实验验证SOCS7与STAT3直接相互作用。抑制SERPINE1或阻断外泌体分泌可显著削弱M2极化,表明let-7g-5p是SERPINE1调控巨噬细胞功能的重要分子。▲图6 胃癌来源的外泌体let-7 g-5p通过STAT3的过度磷酸化促进巨噬细胞M2型极化SERPINE1通过JAK2/STAT3信号驱动免疫抑制
为明确SERPINE1如何调控外泌体let-7g-5p的表达水平,研究探讨了JAK2/STAT3信号通路的作用。实验发现,高表达SERPINE1的胃癌细胞中JAK2和STAT3的磷酸化水平显著升高。
通过FISH和qRT-PCR分析,验证高表达SERPINE1的细胞及外泌体中let-7g-5p显著上调,JAK抑制剂部分逆转了这一现象。此外,利用ChIP-qPCR和双荧光素酶报告基因实验,验证STAT3直接结合到let-7g-5p启动子区域,促进其转录。抑制JAK2/STAT3信号显著降低let-7g-5p水平并削弱M2极化作用。结果表明,SERPINE1通过激活JAK2/STAT3信号调控let-7g-5p表达,从而驱动免疫抑制效应。▲图7 SERPINE1通过JAK2/STAT3通路促进外泌体中let-7 g-5p的表达本论文行文非常严谨扎实,通过临床样本、体外实验和体内模型以及充分的数据分析,深入研究了胃癌中SERPINE1的功能及其通过外泌体调控肿瘤微环境的分子机制,揭示了以下关键点:- SERPINE1的高表达与胃癌的恶性表型显著相关:SERPINE1不仅与晚期胃癌患者的不良预后相关,还与肿瘤微环境中M2型巨噬细胞的高浸润密切相关。
- SERPINE1通过外泌体let-7 g-5p调控M2型巨噬细胞极化:高表达的SERPINE1促进胃癌细胞分泌富含let-7 g-5p的外泌体,该miRNA通过下调SOCS7并激活STAT3信号通路驱动巨噬细胞向M2型转化,增强肿瘤免疫抑制作用。
- SERPINE1通过JAK2/STAT3信号通路调控let-7 g-5p的表达:SERPINE1激活JAK2/STAT3信号,促进let-7 g-5p的转录及其在外泌体中的富集。
通过上述研究,本文不仅揭示了SERPINE1在胃癌发生发展中的关键作用,还探索了其通过外泌体介导肿瘤-免疫细胞相互作用的新机制。这些发现为胃癌患者的靶向治疗提供了潜在的分子靶点,同时也丰富了对肿瘤微环境调控机制的认识。在这项研究中,VectorBuilder云舟生物设计并构建了SERPINE1的过表达和shRNA敲低的慢病毒载体以及其相关对照载体。【参考资料】(下滑查看更多)
1. Ye Z, Yi J, Jiang X, et al. Gastric cancer-derived exosomal let-7 g-5p mediated by SERPINE1 promotes macrophage M2 polarization and gastric cancer progression. J Exp Clin Cancer Res. 2025;44(1):2. Published 2025 Jan 2. doi:10.1186/s13046-024-03269-4
2. Li C, Xu X, Wei S, et al. Tumor-associated macrophages: potential therapeutic strategies and future prospects in cancer. J Immunother Cancer. 2021;9(1):e001341. doi:10.1136/jitc-2020-001341
3. Komohara Y, Jinushi M, Takeya M. Clinical significance of macrophage heterogeneity in human malignant tumors. Cancer Sci. 2014;105(1):1-8. doi:10.1111/cas.12314
4. Ruffell B, Affara NI, Coussens LM. Differential macrophage programming in the tumor microenvironment. Trends Immunol. 2012;33(3):119-126. doi:10.1016/j.it.2011.12.001
5. Isola AL, Chen S. Exosomes: The Messengers of Health and Disease. Curr Neuropharmacol. 2017;15(1):157-165. doi:10.2174/1570159x14666160825160421
6. Clayton A. Cancer cells use exosomes as tools to manipulate immunity and the microenvironment. Oncoimmunology. 2012;1(1):78-80. doi:10.4161/onci.1.1.17826
VectorBuilder云舟生物是世界知名分子生物学家蓝田博士创办的基因递送领军企业,在全球设有10余家子公司和办事处,2023年晋升为全球独角兽企业。
云舟生物独创“载体家”平台,开启了个性化基因载体的商品化时代;目前已赋能全球90多个国家和地区,为超过4500家顶尖科研院校和制药公司提供服务,在QS前100高校的客户覆盖率达到了90%,全球TOP30药企的客户覆盖率亦超过90%,产品成果的全球文献引用量逾5000篇。
云舟生物的基因药物CRO、CDMO项目遍布北美、欧洲、日本等多个国家和地区,已成功助力全球数十个项目成功开展IIT或IND研究,其中GMP级别的质粒和慢病毒载体已获得美国FDA的IND正式批准,用于在美国的多中心临床试验。
云舟生物致力于系统性攻克基因递送行业的关键技术瓶颈,为行业和世界创造不可取代的价值。