老年听力衰退的根源找到了?中科院揭示灵长类耳蜗衰老与SLC35F1缺陷有关
发布时间:2025-08-04 10:30分类: 无 浏览:13评论:0

老年性耳聋正成为全球范围内日益严峻的公共卫生挑战,它不仅会影响老年人的语言理解和交流,还可能引发社交障碍、认知衰退,甚至增加阿尔茨海默病的患病风险。耳蜗衰老是导致老年性耳聋的主要原因,这个过程涉及感觉毛细胞丢失、螺旋神经节神经元衰老伴随神经炎症加剧、血管纹萎缩等一系列病理变化,但目前耳蜗衰老的具体机制还不明确。
单细胞转录组技术为解析复杂组织的细胞组成与状态提供了高分辨率工具,而非人灵长类动物因为与人类在遗传和生理上高度相似,成为研究耳蜗衰老的理想模型。不过现有研究还比较欠缺,细胞类型特异的衰老机制不清楚,这在一定程度上制约了相关干预策略的开发。
2025年6月,中国科学院动物研究所刘光慧、曲静团队,联合东南大学柴人杰、首都医科大学王思等团队,在Nature Aging发表了一篇题为Single-cell profiling identifies hair cell SLC35F1 deficiency as a signature of primate cochlear aging的论文。这项研究通过单细胞转录组学和组织病理学分析,系统揭示了灵长类耳蜗衰老的细胞与分子特征,明确了毛细胞SLC35F1缺陷是其衰老的关键标志,还验证了二甲双胍在延缓耳蜗衰老中的潜力,为开发针对年龄相关听力损失的干预策略奠定了基础。

灵长类耳蜗衰老的表型特征
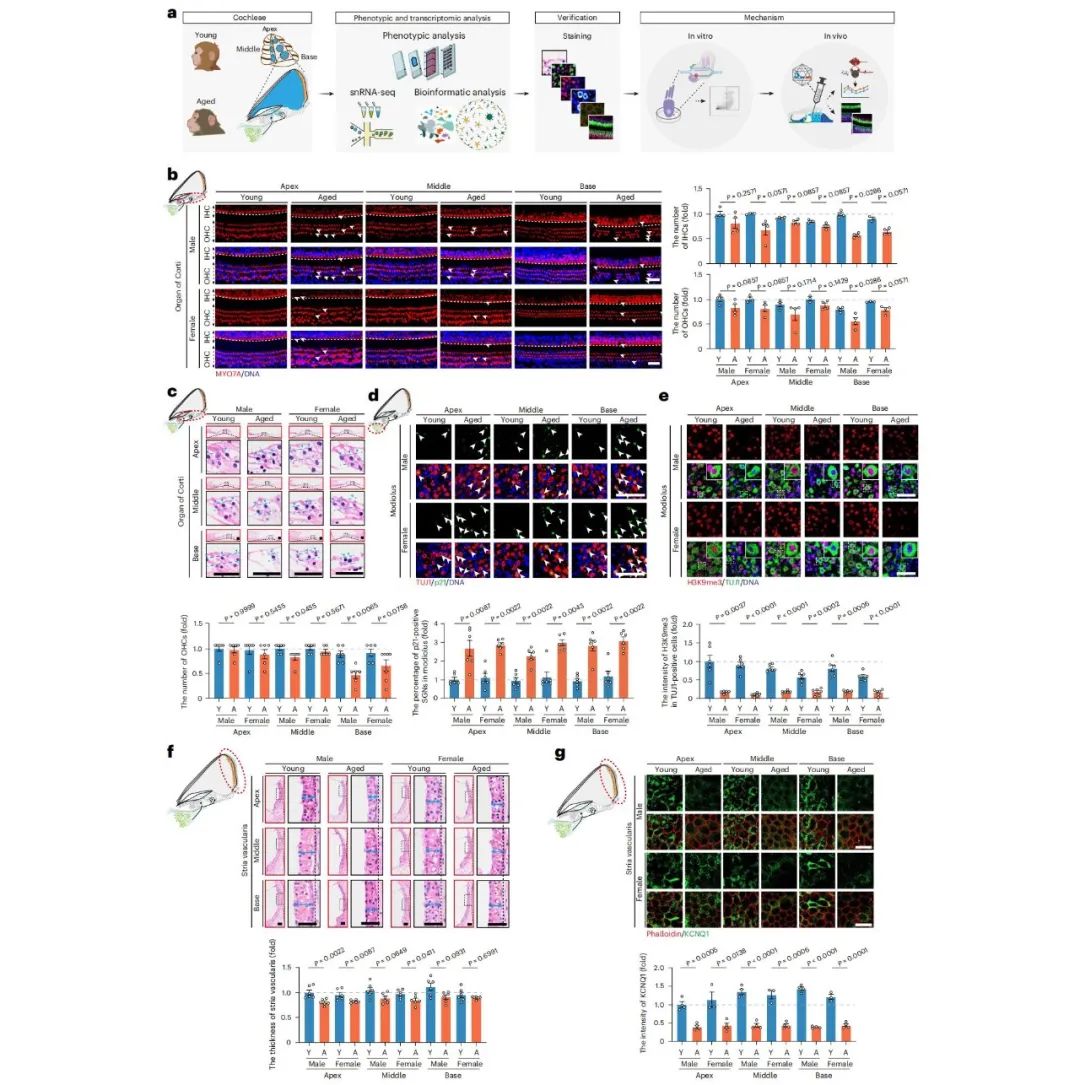
耳蜗衰老的单细胞图谱构建
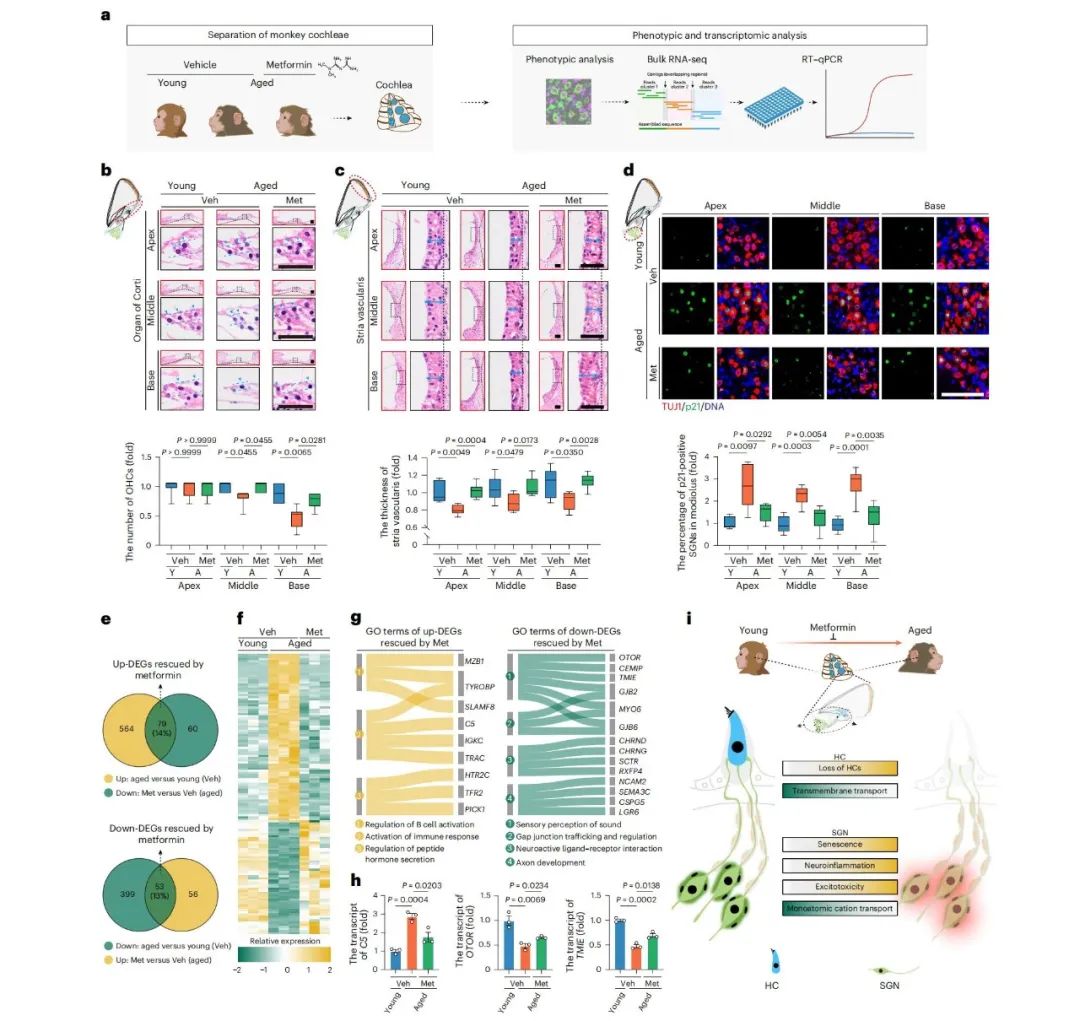
该研究建立了灵长类耳蜗的单核转录组图谱。经过质量控制后,获得了157,026个高质量细胞核表达谱,研究人员利用深度学习模型scBERT注释细胞类型,并参考小鼠耳蜗单细胞数据,识别出包括Corti器、蜗轴、血管纹及免疫细胞在内的24类细胞类型。
此外,还明确了内毛细胞(以SYNE1、SLC1A3为标记)、外毛细胞(以SLC26A5、KCNQ4为标记)及螺旋神经节中4种神经元亚型的分子特征,这为后续的功能研究做好了铺垫。
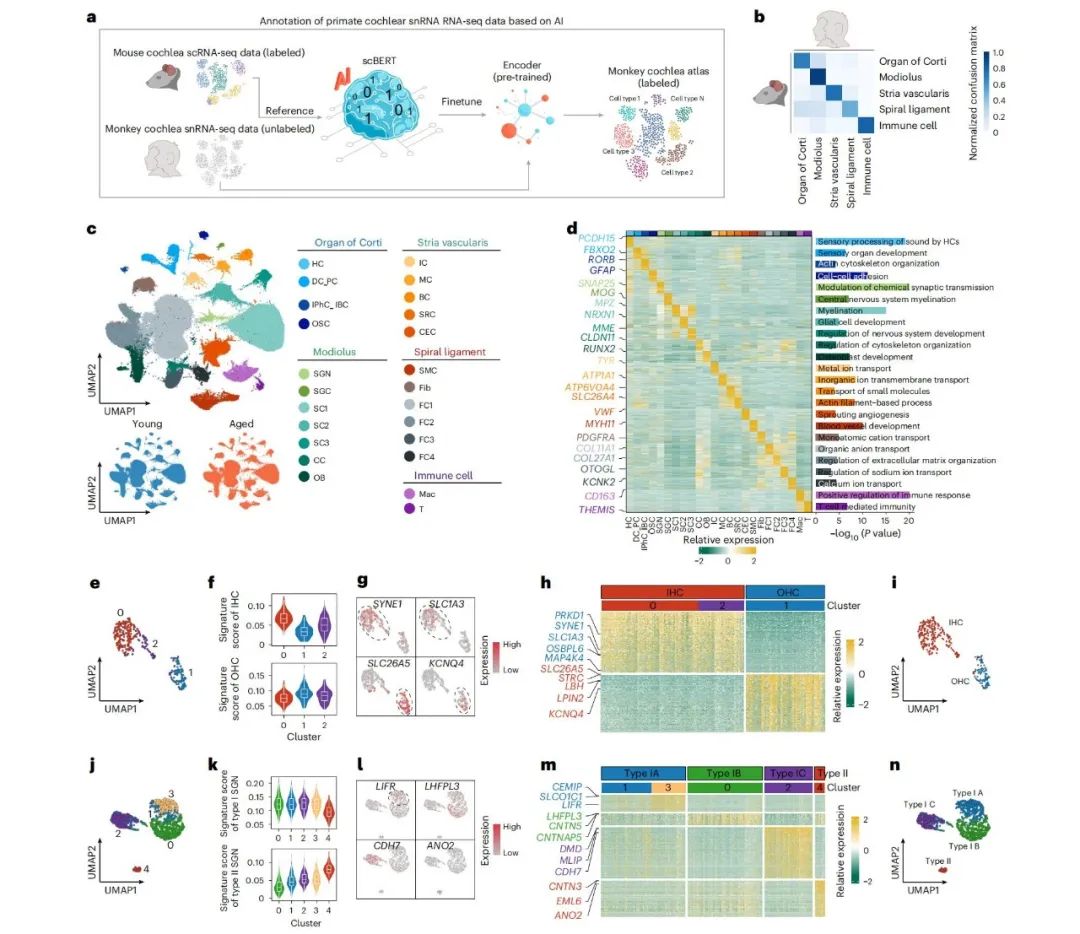
灵耳蜗衰老的全局转录特征
耳蜗衰老的分子调控机制
转录调控网络分析发现,BHLHE40、TCF4与ZBTB40等转录因子在调控差异表达基因中起到了关键作用,参与到神经炎症与神经元功能调节中。
细胞互作分析显示,耳蜗内各类细胞的通讯强度会随着年龄增加而增强,尤其是炎症通路相关的相互作用上调明显,而像蜗轴的化学突触传导这类与区域功能相关的通路则呈下调趋势。比如C3与IFITM1的配对可能会促进巨噬细胞迁移与激活,推动免疫环境重塑。

感音神经性听力损失的分子基础
研究还发现,与感音神经性、感觉性及混合性听力障碍相关的多个基因,在衰老耳蜗中表达异常。蜗轴中的卫星胶质细胞、螺旋神经节神经元及Corti器毛细胞都表现出显著的转录噪音升高。
这些转录波动与关键衰老相关基因高度重叠,例如ALS2的下调可能导致神经信号传导障碍,免疫荧光进一步证实该基因在TUJ1阳性神经元中的表达会随着年龄下降。
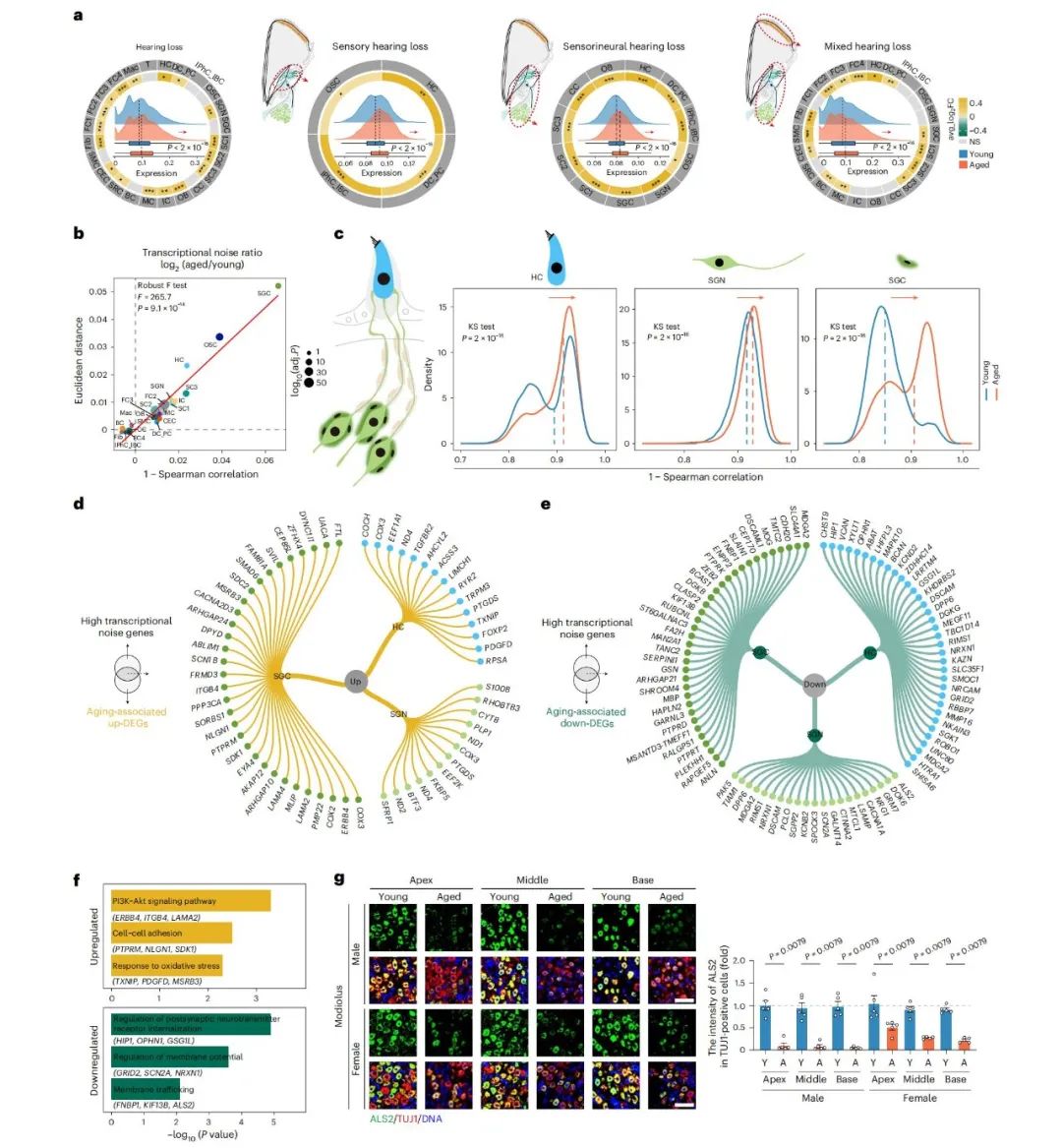
图
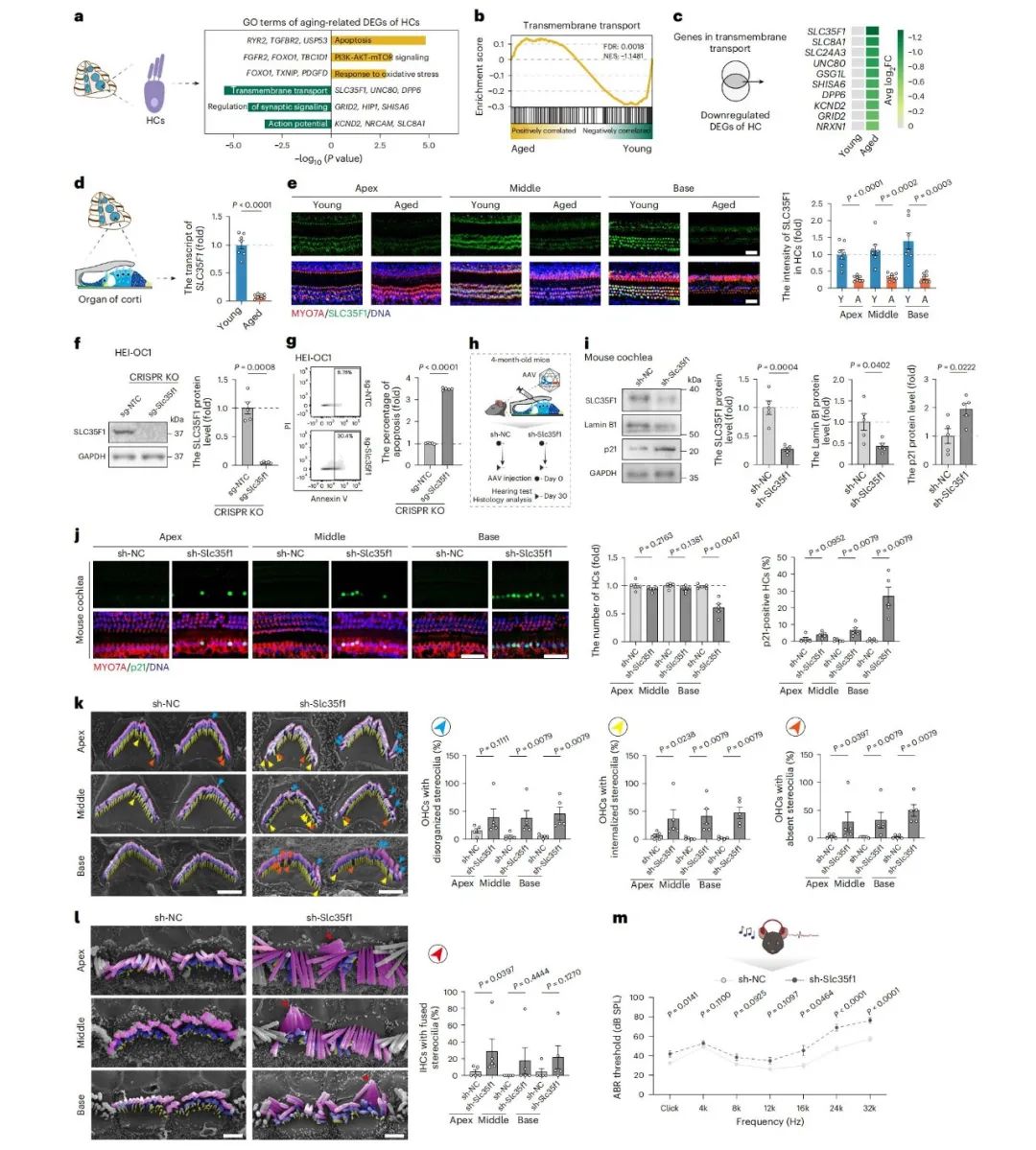
SLC35F1缺陷导致听力损害
体外实验中,通过敲低HEI-OC1细胞中的Slc35f1或Unc80,观察到细胞凋亡增加;体内实验利用AAV介导敲低小鼠耳蜗毛细胞中的Slc35f1,导致毛细胞退化、静纤毛结构紊乱、衰老标志物异常,以及听觉脑干反应阈值升高。这些结果都证实了SLC35F1在维持毛细胞稳态和保护听觉功能中的关键作用。
二甲双胍延缓灵长类耳蜗衰老
基于二甲双胍的抗衰老特性,研究对年老猴进行了为期3.3年的临床剂量(20 mg/kg)干预,结果显示二甲双胍能有效延缓耳蜗衰老,具体表现为毛细胞数量增加、血管纹厚度恢复、螺旋神经节中p21阳性衰老细胞数量减少。
转录组分析揭示,二甲双胍可逆转14%的衰老上调基因及13%的衰老下调基因,其中包括下调的炎症因子C5及上调的听觉功能基因OTOR、TMIE等,这提示其通过多通路协同作用发挥延缓效应。
图
这项研究首次从单细胞维度系统描绘了灵长类耳蜗衰老的细胞图谱与分子特征,识别出毛细胞中SLC35F1的表达缺陷是耳蜗衰老的关键标志,并验证了其在维持毛细胞稳态与听觉功能中的核心作用。同时,研究提出了利用二甲双胍延缓耳蜗衰老的新策略,为年龄相关听力损失的靶向干预提供了重要的实验依据和理论支持。
不过,SLC35F1如何具体调控毛细胞老化过程,其在听觉信号转导中的下游作用机制,以及二甲双胍干预耳蜗衰老的完整分子通路,还有待进一步阐明。
总的来说,这项研究不仅填补了灵长类耳蜗衰老机制的研究空白,也为研发防治老年性耳聋的靶向新策略提供了新思路,具有重要的科学意义与临床转化潜力。
VectorBuilder云舟生物为该研究提供了pAAV[shRNA]-eGFP-U6载体(货号:VB010000-9461vph)。研究团队将载体中的eGFP报告基因替换为mNeoGreen,构建出pAAV-mNeoGreen载体,并在此基础上插入打靶Slc35f1基因的shRNA,用于后续的基因敲低实验和相关研究工作。
参考文献:Sun G, ..., Liu G-H. Single-cell profiling identifies hair cell SLC35F1 deficiency as a signature of primate cochlear aging[J]. Nat Aging, 2025. DOI: 10.1038/s43587-025-00896-0. PMID: 40542214.
VectorBuilder云舟生物是世界知名分子生物学家蓝田博士创办的基因递送领军企业,在全球设有10余家子公司和办事处,2023年晋升为全球独角兽企业。
云舟生物独创“载体家”平台,开启了个性化基因载体的商品化时代;目前已赋能全球130多个国家和地区,为超过7000家顶尖科研院校和制药公司提供服务,在QS前100高校的客户覆盖率达到了90%,全球TOP30药企的客户覆盖率亦超过90%,产品成果的全球文献引用量逾7000篇。
云舟生物的基因药物CRO、CDMO项目遍布北美、欧洲、日本等多个国家和地区,已成功助力全球数十个项目成功开展IIT或IND研究,其中GMP级别的质粒和慢病毒载体已获得美国FDA的IND正式批准,用于在美国的多中心临床试验。
云舟生物致力于系统性攻克基因递送行业的关键技术瓶颈,为行业和世界创造不可取代的价值。






- 排行


