刷新认知!英国伦敦大学首次揭示阿尔茨海默病中Aβ生成的新源头
发布时间:2025-05-09 05:03分类: 无 浏览:66评论:0

阿尔茨海默病(Alzheimer's Disease, AD)是一种严重影响全球老年人群体的神经退行性疾病,目前全球约有5000万患者,且这一数字正随着全球老龄化问题的加剧而不断上升。AD患者通常表现为记忆丧失、认知障碍、行为改变等症状,病程长且治疗手段有限。β-淀粉样蛋白(Aβ)的积累是该疾病的早期关键标志,也是理解病理生理学和治疗的重要靶点。随着Aβ的逐渐积聚,患者的神经元和神经回路受到严重损害,导致认知和功能的衰退。
虽然目前普遍认为神经元是致病性Aβ的主要来源,但这一假设未经检验。近年来的转录组学研究表明,在人类AD组织和小鼠模型中,除了神经元外,小胶质细胞、星形胶质细胞以及少突胶质细胞也在AD中表现出显著变化。尤其是少突胶质细胞,不仅参与大脑的髓鞘生成,还能在特定情况下产生Aβ,而这与阿尔茨海默病的发生和发展密切相关。

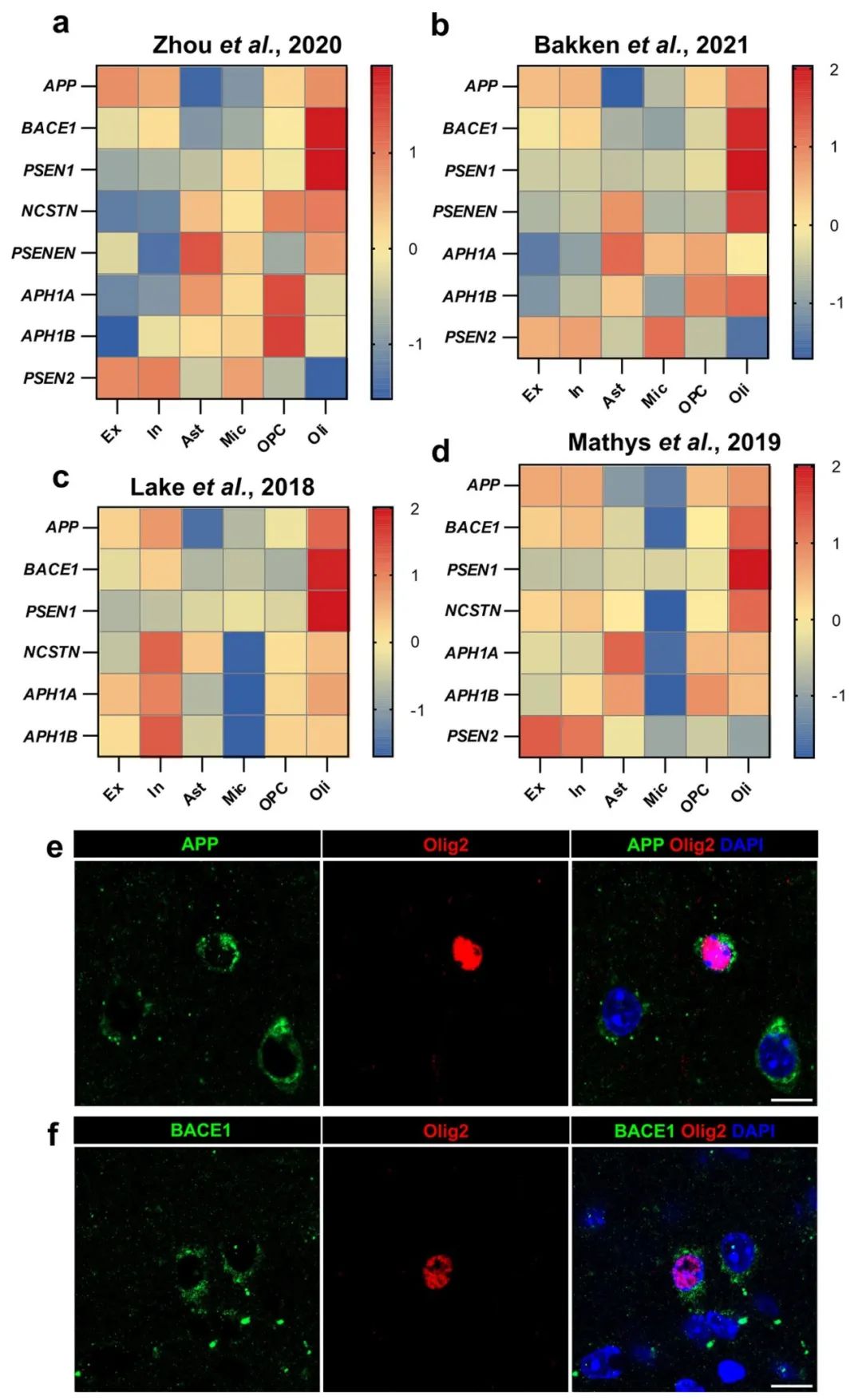
为了确定大脑当中能够产生Aβ的细胞类型,作者通过对公开的人类单核RNA测序数据进行分析发现,少突胶质细胞中参与Aβ产生的核心基因(如APP、BACE1和γ-分泌酶复合物的组成部分,如PSEN1、PSEN2、NCSTN等)表达量显著升高,且这些基因的表达在少突胶质细胞中普遍高于大脑中其他细胞类型,包括神经元。进一步的蛋白质组学分析和免疫组织化学染色确认,少突胶质细胞不仅在基因层面具备生成Aβ的能力,蛋白质水平也含有所需的关键成分。
这些研究结果表明,少突胶质细胞在Aβ生成过程中发挥了关键作用,挑战了长期以来认为Aβ主要由神经元产生的观点。因此,研究人员推测,少突胶质细胞可能是Aβ生成的重要来源之一。这一发现为我们理解少突胶质细胞在AD中的潜在作用提供了新视角,尤其是在AD的病理背景下,少突胶质细胞可能通过生成Aβ参与疾病进展。
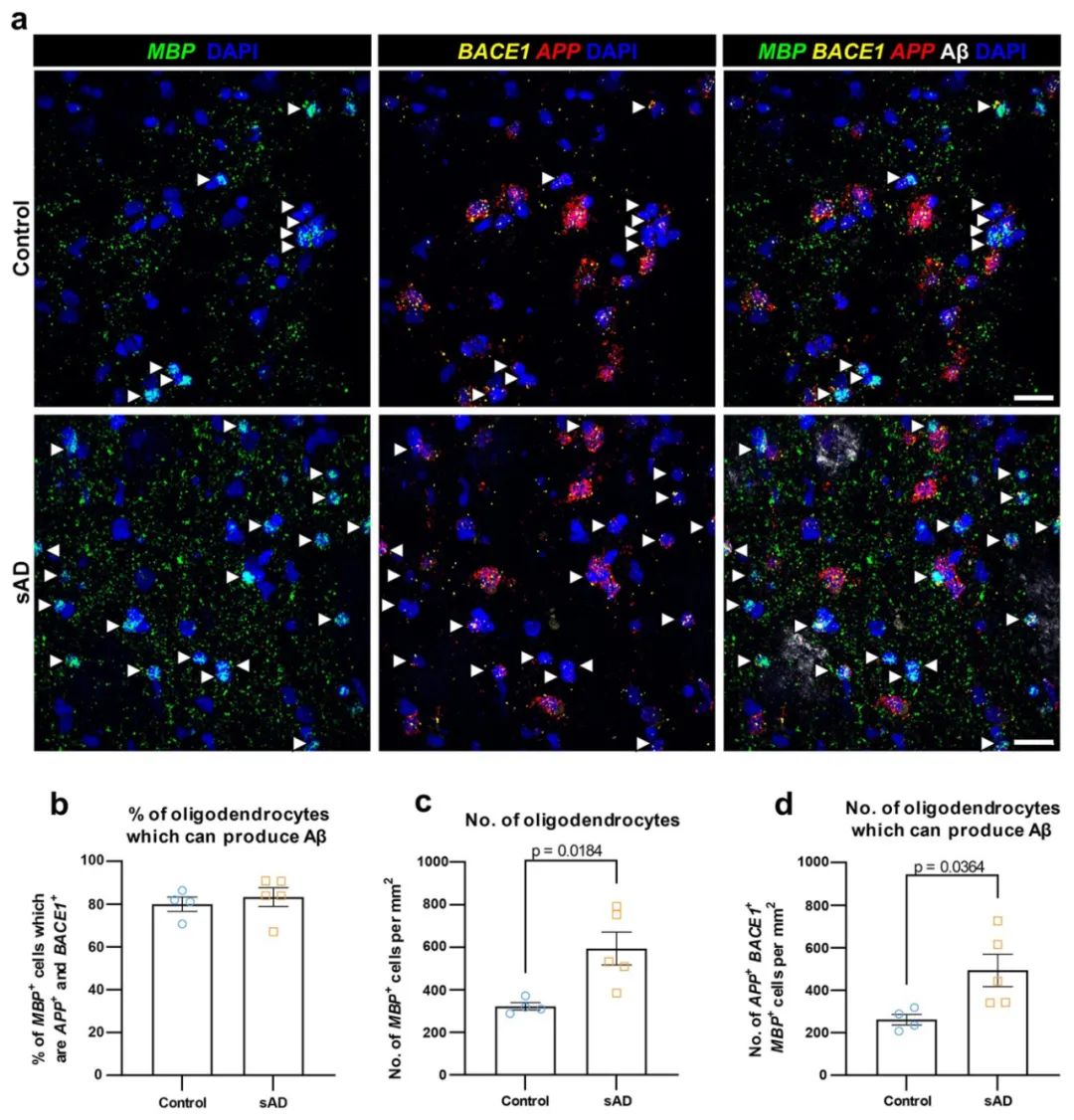
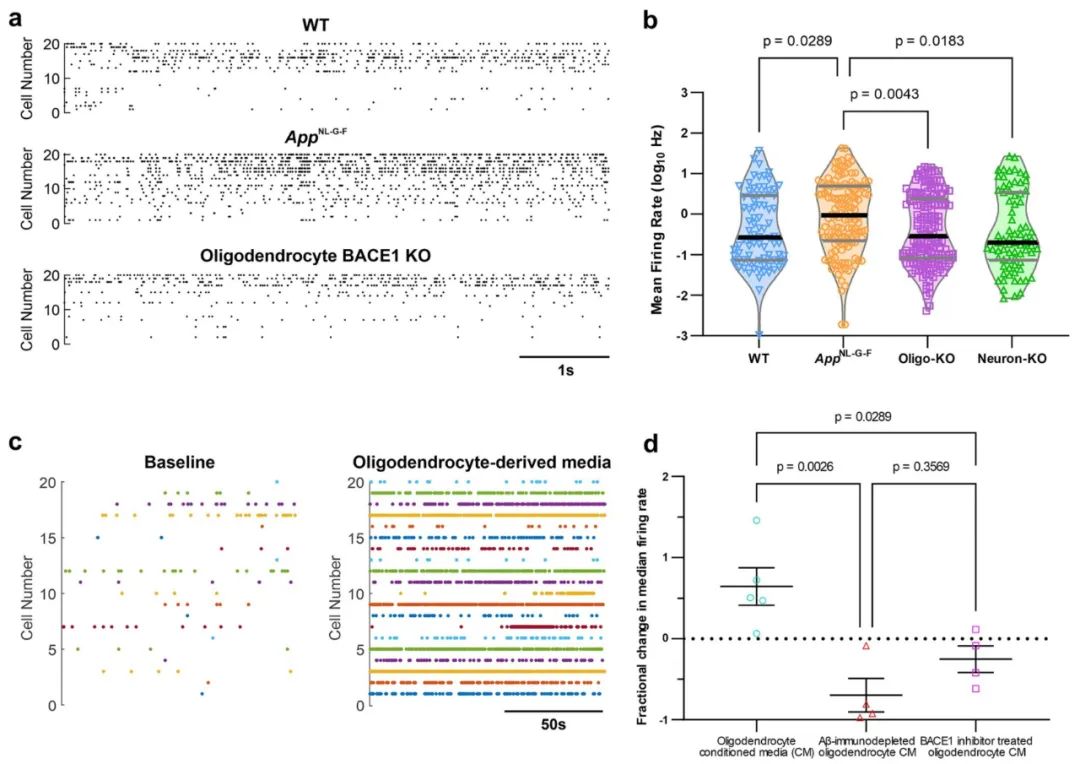
通过对人类散发性阿尔茨海默病(sAD)患者的大脑后期组织进行RNAscope原位杂交和免疫组织化学分析,研究发现AD患者的少突胶质细胞数量显著增多,且约80%的少突胶质细胞具备产生Aβ的能力。具体来说,这些能够产生Aβ的少突胶质细胞主要集中在大脑皮层的第5和第6层。与健康对照组相比,AD患者的大脑中少突胶质细胞数量增多,而其他细胞类型(尤其是神经元)数量没有发生类似变化。
这一结果表明这与AD的病理发展密切相关,提示少突胶质细胞在AD的早期阶段可能通过产生Aβ对疾病的进展起到重要的推动作用。
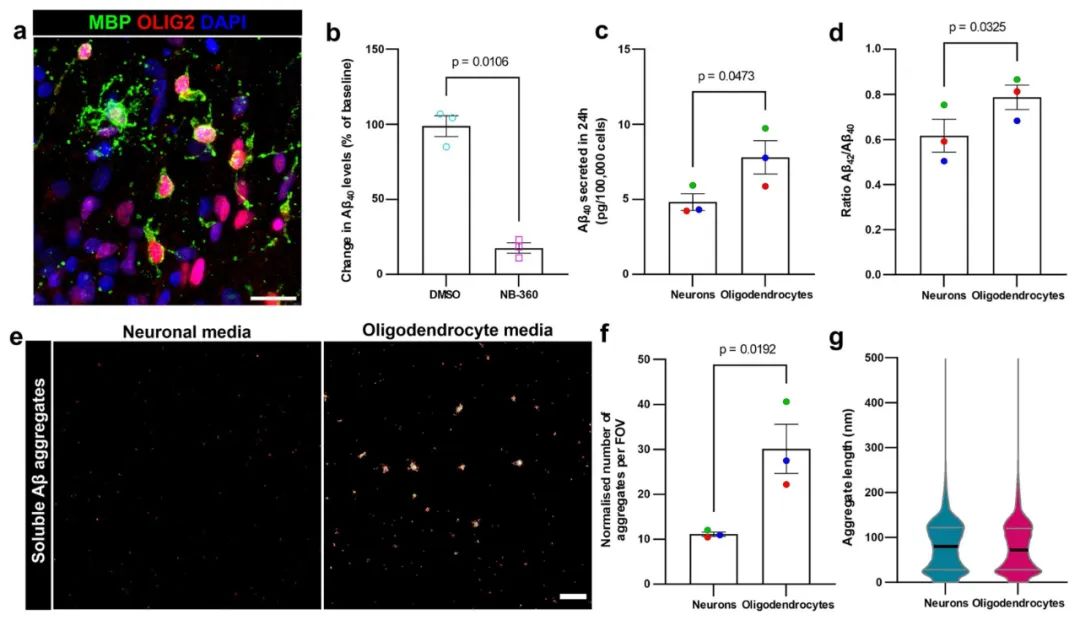
为了进一步验证少突胶质细胞是否会产生、如何产生Aβ,以及产生的Aβ的类型,研究者采用了人类诱导多能干细胞(iPSCs)衍生的少突胶质细胞模型。通过诱导带有AD家族性突变(如PSEN1)的iPSCs,成功分化出少突胶质细胞,并发现这些iPSC衍生的少突胶质细胞在培养过程中能够显著产生Aβ。更进一步的分析表明,Aβ的生成依赖于β-分泌酶(BACE1)的活性,使用BACE1抑制剂(如NB-360)能显著减少Aβ的生成,这表明Aβ产生过程依赖于BACE1的酶促作用。
通过这些iPSC衍生的少突胶质细胞模型,研究不仅验证了少突胶质细胞在AD中的Aβ产生能力,还发现少突胶质细胞生成的Aβ量明显高于相同细胞系的神经元,且Aβ42/40的比例更高,生成的可溶性Aβ聚集体也更多。这一发现进一步证明,少突胶质细胞是Aβ的一个重要来源,为通过改变少突胶质细胞功能来干预AD提供了实验支持。
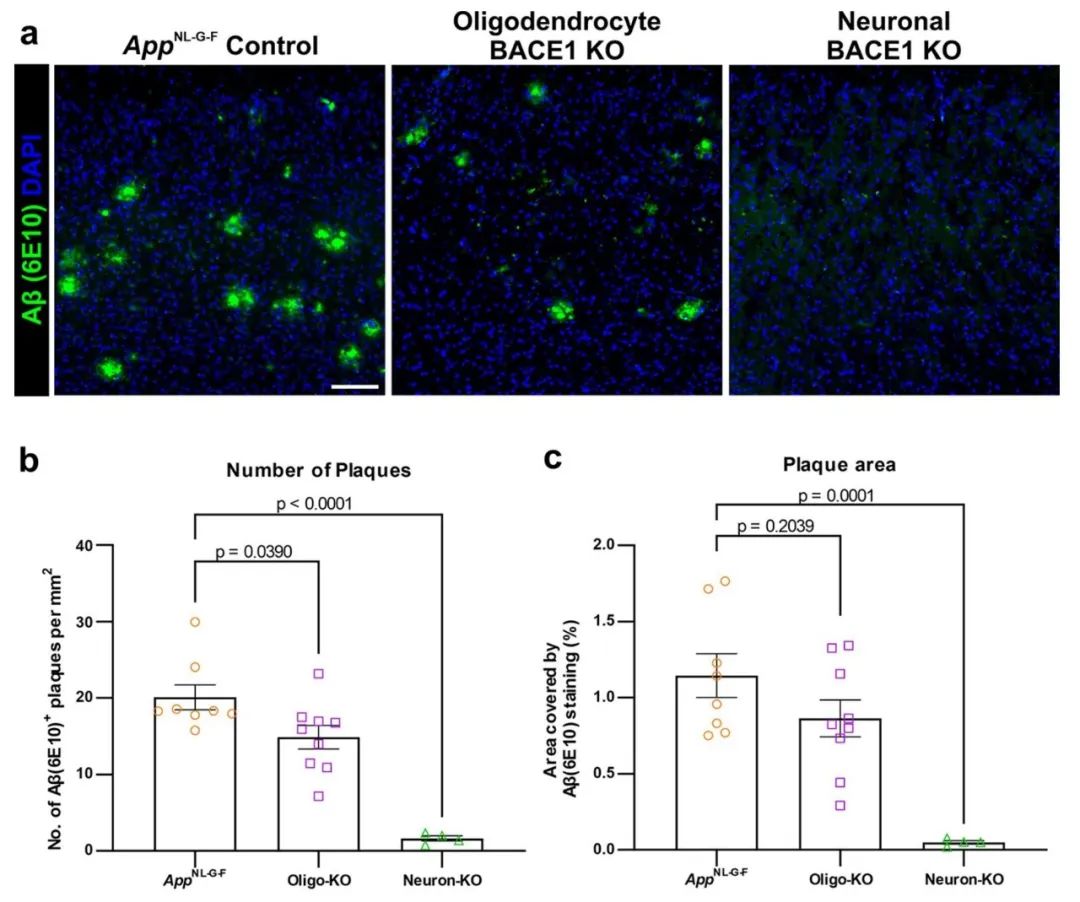
研究人员使用了AppNL-G-F小鼠模型,直接研究在体内少突胶质细胞来源的Aβ在斑块形成中的作用。该模型能够在脑内生成Aβ斑块,成为研究Aβ积累与神经退行性疾病关系的重要工具。研究人员通过特异性敲除小鼠中少突胶质细胞中的BACE1基因,成功减少了少突胶质细胞对Aβ的产生,并观察了Aβ斑块的变化。
研究结果表明,抑制少突胶质细胞中的Aβ产生后,皮质区域(包括视觉、回溯皮层和运动皮层)Aβ斑块的数量减少了约25%。特别是在回溯皮层的5/6层,斑块面积减少更为显著,而在海马CA1区和胼胝体也表现出类似的趋势。相比之下,当神经元中特异性敲除BACE1时,几乎完全消除了皮质内的Aβ斑块,显示出神经元在Aβ生成中的主导作用。
在进一步的实验中,研究团队验证了通过抑制少突胶质细胞Aβ产生对神经功能恢复的效果。在AppNL-G-F小鼠模型中,研究人员通过特异性敲除BACE1基因,成功抑制了少突胶质细胞的Aβ产生,并观察到神经元发放活动得到了显著恢复,尤其是在皮层区域的神经活动恢复至接近健康小鼠的水平。此结果表明,少突胶质细胞来源的Aβ在AD早期神经元的过度兴奋中扮演着关键角色,抑制Aβ的生成能够有效恢复正常的神经功能。
此外,在3个月大的清醒小鼠中进行的实验中,通过少突胶质细胞特异性敲除BACE1,研究人员消除了AppNL-G-F小鼠早期的神经元过度活跃表型,恢复了神经元的放电水平和时间结构。进一步实验表明,当向野生型小鼠回溯皮层注射含有可溶性Aβ聚集体的人类fAD iPSC衍生少突胶质细胞条件培养基时,神经元的放电率显著增加。然而,注射经过免疫去除Aβ或BACE1抑制剂处理的少突胶质细胞培养基,则未见此效应。
本研究聚焦于阿尔茨海默病(AD)中的少突胶质细胞及其与β-淀粉样蛋白(Aβ)产生的关系。长期以来,Aβ被认为主要由神经元产生,但本文挑战了这一传统观点,通过多种实验方法揭示了少突胶质细胞在Aβ生成中的重要作用。
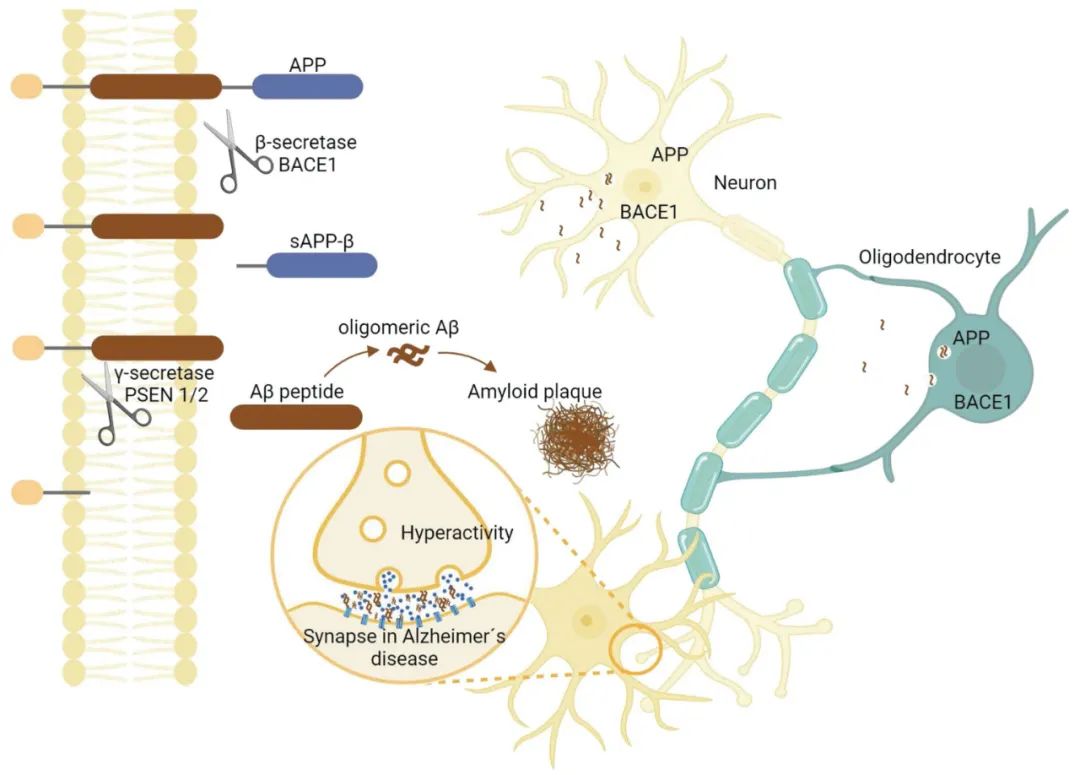
图6 跨膜蛋白APP在少突胶质细胞中依次被β-分泌酶(BACE1)和γ-分泌酶(PSEN1/2)切割,导致特定的高Aβ42/40比率。释放的Aβ肽具有聚集成寡聚体的能力,这可能导致突触功能障碍,并伴随神经元的过度活跃
作者通过转录组分析、免疫组织化学染色以及iPSC衍生的细胞实验,证实少突胶质细胞不仅具有生成Aβ的潜力,而且在AD患者的大脑中,这些细胞的数量和Aβ生成能力都有所增加。此外,本文进一步探讨了通过抑制少突胶质细胞Aβ生成来恢复AD小鼠模型中的神经功能异常,证明了少突胶质细胞来源的Aβ在AD早期的神经元过度兴奋和功能障碍中起着关键作用。
这些研究结果为AD的治疗提供了新的视角,即通过靶向少突胶质细胞中的Aβ生成,有望开发出新的治疗策略。
云舟生物(VectorBuilder)为本研究提供了SON慢病毒包装服务,帮助实现神经前体细胞(NPCs)基因的转导。
VectorBuilder云舟生物是世界知名分子生物学家蓝田博士创办的基因递送领军企业,在全球设有10余家子公司和办事处,2023年晋升为全球独角兽企业。
云舟生物独创“载体家”平台,开启了个性化基因载体的商品化时代;目前已赋能全球90多个国家和地区,为超过4500家顶尖科研院校和制药公司提供服务,在QS前100高校的客户覆盖率达到了90%,全球TOP30药企的客户覆盖率亦超过90%,产品成果的全球文献引用量逾5000篇。
云舟生物的基因药物CRO、CDMO项目遍布北美、欧洲、日本等多个国家和地区,已成功助力全球数十个项目成功开展IIT或IND研究,其中GMP级别的质粒和慢病毒载体已获得美国FDA的IND正式批准,用于在美国的多中心临床试验。
云舟生物致力于系统性攻克基因递送行业的关键技术瓶颈,为行业和世界创造不可取代的价值。






- 排行
